Enlace iónico
Un enlace iónico es una atracción electrostática que une iones de cargas opuestas en compuestos iónicos o en fenómenos superficiales, típicamente de la esfera externa. Como enlace electrovalente, generalmente se asocia con un enlace covalente.
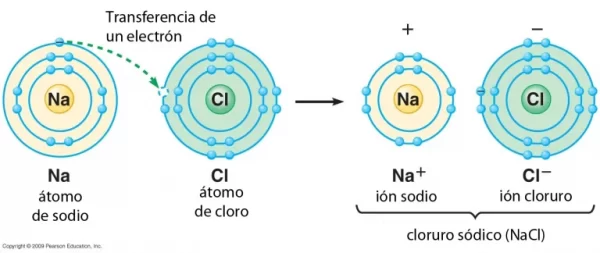
Durante el enlace iónico, dos átomos, generalmente uno metálico y otro no metálico, intercambian electrones de valencia; este proceso se llama ‘transferencia de electrones’. El metal pierde electrones para convertirse en un catión con carga positiva y que el no metal acepta estos electrones para convertirse en un anión con carga negativa. Cuando los dos iones se combinan a través de un enlace iónico, forman compuestos iónicos.
Tabla de contenidos
Características y propiedades
Las principales características y propiedades de un enlace iónico son:
- Alto punto de fusión y ebullición: las fuerzas de unión no dirigidas en los cristales crean una unión relativamente estable en todo el cristal.
- Conductor en la masa fundida o en solución: los iones se encargan del transporte de carga. Se descargan en los electrodos, que descomponen las sales, generalmente en sus elementos. Esta es la razón por la que los conductores de iones se denominan conductores de segundo orden.
- Duro y quebradizo: cuando se intenta deformar plásticamente un cristal, generalmente estalla porque los iones con la misma carga se empujan entre sí en el cristal y, por lo tanto, se rompe el enlace.
- Las sales se disocian en sus correspondientes iones en solución acuosa: por lo que los compuestos iónicos son solubles en agua, pero en un grado muy diferente. Por ejemplo, el cloruro de sodio es muy soluble en agua, mientras que el cloruro de plata es casi insoluble.
- Formación de cristales sólidos e incoloros: los electrones de valencia suelen estar fuertemente unidos y solo pueden ser excitados por fotones de mayor energía que la de la luz visible.
Información
El enlace iónico fue formulado por Walter Kossel alrededor de 1916.
A partir de una diferencia de electronegatividad de ΔEN = 1,7 se habla de un 50% de carácter parcialmente iónico. Si la diferencia es mayor que 1,7, entonces hay enlaces iónicos, incluidos enlaces polares, predominantemente covalentes. Sin embargo, estos son límites relativamente arbitrarios, ya que el caso del enlace iónico puro representa una idealización.
Las fórmulas químicas que reflejan las proporciones de elementos que interactúan y que se encuentran en un sólido iónico (sal), se pueden usar para definir compuestos iónicos. Las fórmulas empíricas se utilizan comúnmente para representar sólidos iónicos.
Estos elementos se representan en notación de fórmulas mediante sus símbolos químicos, seguidos de subíndices numéricos que muestran las proporciones relativas de los átomos que los componen.
Ejemplos
Fórmula iónica del hidróxido de calcio: el hidróxido de calcio contiene iones Ca 2+ y OH-.
- Se trata de dos cargas positivas y una carga negativa.
- Para que el número de cargas sea el mismo, necesita un ion Ca 2+ y dos iones OH-.
- Por tanto, la fórmula es Ca (OH) 2.
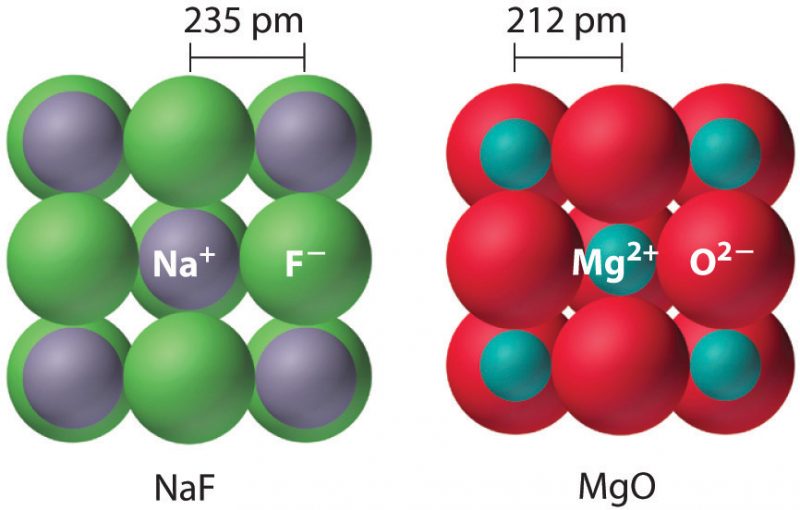
Fórmula iónica del óxido de magnesio: el óxido de magnesio contiene iones Mg2 + y O2-.
- Se trata de dos cargas positivas y dos cargas negativas.
- El número de cargas ya es el mismo.
- Por lo tanto, la fórmula es MgO.
Fórmula iónica del cloruro de sodio: el cloruro de sodio contiene iones de Na + y Cl-.
- Es una carga positiva y una carga negativa.
- El número de cargas ya es el mismo.
- Por tanto, la fórmula es NaCl.
Diferencia entre enlaces iónicos y covalentes
Los dos tipos principales de enlaces químicos son los enlaces iónicos y los enlaces covalentes, pero existen algunas diferencias clave entre los dos:
Enlaces iónicos:
- Enlace entre metales y no metales
- Implica la transferencia completa de electrones
- Ocurre entre iones con electronegatividades considerablemente diferentes
Enlaces covalentes:
- Enlace entre no metales
- Implica compartir electrones
- Ocurre entre átomos con electronegatividades similares
Mientras que los enlaces iónicos implican la transferencia completa de electrones entre átomos, los enlaces covalentes se forman cuando dos átomos comparten electrones. Esto suele tener lugar entre átomos de un mismo elemento o entre dos elementos que están próximos entre sí en la tabla periódica.
Es más probable que se formen enlaces covalentes entre dos átomos con electronegatividades similares (es decir, aquellos con una capacidad similar para atraer electrones). Por lo general, ocurren entre dos no metales, aunque también se pueden observar entre metales y no metales.
Los enlaces iónicos son generalmente más fuertes que los enlaces covalentes debido a la atracción electrostática que existe entre iones con carga opuesta.
Referencias
- Scielo. (2010). Iónico, covalente y metálico. website: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-893X2010000200003
- Castillo, M.-. Enlace iónico vs enlace covalente. Repositorio Académico Digital de la Universidad Autónoma del Estado de Hidalgo. website: https://repository.uaeh.edu.mx/revistas/index.php/prepa4/article/view/3216/3189
- Colegio de Ciencias y Humanidades.-. Enlace iónico, de Universidad Nacional Autónoma de México(UNAM). website: https://e1.portalacademico.cch.unam.mx/alumno/quimica1/unidad2/tiposdeenlaces/enlaceionico