Enlace covalente

Un enlace covalente consiste en la atracción simultánea de dos núcleos por uno o más pares de electrones. Estos enlaces se producen entre átomos idénticos o entre diferentes átomos cuya diferencia de electronegatividad es insuficiente para permitir la transferencia de electrones para formar iones. Por lo tanto, los enlaces covalentes son el medio de enlace más importante en química orgánica.
Tabla de contenidos
Características

Algunos enlaces covalentes (entre diferentes átomos) se caracterizan por una concentración de electronegatividad en uno de los dos átomos juntos. Esto es debido a que no atraen la nube de electrones circundante con la misma intensidad, dando como resultado un dipolo eléctrico, es decir, una molécula con una carga positiva y negativa en sus extremos, como una batería ordinaria: un polo positivo y un polo negativo.
Gracias a esto, las moléculas covalentes se unen con moléculas similares y forman estructuras más complejas.
Tipos de enlace covalente
Aquí se describen los tipos de superposición orbital que ocurren en enlaces simples, dobles, triples y dativo.
- Simple: un enlace covalente simple en el que ambos electrones del par compartido provienen del mismo átomo se llama enlace covalente coordinado. Para indicar un enlace covalente coordinado, a veces se dibuja una flecha desde el átomo que dona el par de electrones hacia el átomo con el que se comparte el par.
- Doble: un doble enlace covalente es el tipo de enlace químico en el que dos pares de electrones se comparten entre los dos átomos. Este tipo de enlace covalente incluye cuatro electrones de enlace entre átomos en lugar de los dos electrones de enlace habituales que están involucrados en un enlace simple.
- Triple: un enlace covalente triple implica el intercambio de tres pares de electrones, es decir, seis electrones. Los átomos se combinan para completar su capa de valencia (la más externa) y volverse estables.
- Dativo: un enlace dativo también se denomina enlace covalente coordinado. Es ese tipo de enlace químico en el que un átomo proporciona un par de electrones compartidos para la formación de un enlace.
La razón por la que se donan diferentes cantidades de electrones es porque los átomos siempre intentan llenar su capa exterior y, a generalmente, una capa exterior puede llenarse más si se comparte más de un par de electrones.
Propiedades

Los compuestos covalentes suelen tener puntos de fusión bajos. Una excepción a esto incluye moléculas de sílice y diamantes que tienen un alto punto de fusión.
Estos compuestos tienen puntos de ebullición bajos. Esto se puede atribuir a su débil fuerza de atracción entre los diversos átomos enlazados. Las fuerzas de Van Der Waals unen estos átomos.
Suelen ser gases y líquidos con puntos de fusión y de ebullición bajos. En cuanto a los compuestos covalentes sólidos, tienen estructuras blandas como el grafito. Esto se debe a la presencia de una nube de electrones entre cada capa de átomos de carbono.
Estos compuestos no son conductores de carga eléctrica; la ausencia de iones cargados es la principal razón detrás de esto. Una excepción a esto es el grafito, donde se observa una nube de electrones que hace que el grafito sea un buen conductor.
Otra característica de los enlaces covalentes es que son malos conductores de calor. Sus moléculas carecen de electrones libres y eso obstruye el flujo de energía térmica.
Tampoco poseen características polares como propiedad general. Por lo tanto, estos compuestos son insolubles en agua. Las moléculas de agua no son absolutamente neutrales y tienen una ligera carga negativa en el átomo de oxígeno y ligeras cargas positivas en los átomos de hidrógeno y dado que los compuestos covalentes están formados por moléculas neutras o moléculas con cargas ligeras y, por lo tanto, no son atraídas fuertemente por las moléculas de agua.
Ejemplos
Algunos ejemplos simples de enlace covalente son los que se muestra en las siguientes moléculas:
- Oxígeno puro (O2). O = O (un doble enlace).
- Hidrógeno puro (H2). HH (un solo enlace).
- Dióxido de carbono (CO2). O = C = O (dos dobles enlaces).
- Agua (H2O). HOH (dos enlaces simples).
- Ácido clorhídrico (HCl). H-Cl (un solo enlace).
- Nitrógeno puro (N2). N≡N (un triple enlace).
- Ácido cianhídrico (HCN). HC≡N (enlace simple y triple).
Diferencia entre enlaces covalentes e iónicos
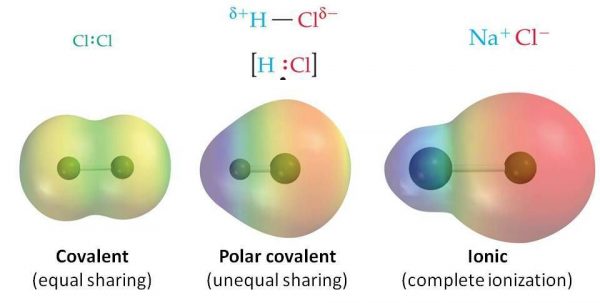
Los enlaces covalentes se forman entre dos no metales, mientras que los enlaces iónicos se forman entre un metal y un no metal. Ambos tipos de enlaces implican la formación de capas completas de electrones externos.
- Se forman enlaces iónicos entre metales y no metales, mientras que se forman enlaces covalentes entre dos no metales.
- Los enlaces iónicos implican la formación de iones y los iones se mantienen en su lugar por interacción electrostática.
- Los enlaces covalentes implican el intercambio de electrones entre átomos (no iones). Los enlaces iónicos pueden formar una red iónica.
- Las moléculas unidas covalentemente pueden formar una estructura covalente.