Tabla periódica de los elementos

La tabla periódica de los elementos químicos, es una clasificación natural de los elementos químicos y expresión tabular de la Ley Periódica formulada por el químico ruso Dmitri Ivanovich Mendeleev, uno de los mayores descubrimientos científicos y la base del conocimiento moderno de la química.
Esta tabla contiene una clasificación de todos los elementos químicos conocidos por la humanidad, componentes fundamentales que conforman toda la materia de la Tierra y el Universo entero.
El número de elementos de la tabla periódica moderna contiene 118 elementos, casi el doble de los elementos conocidos a mediados del siglo XIX, su estructura no ha cambiado mucho desde la época de Mendeleev, y aunque se han publicado más de 50 variantes en toda la historia de la tabla periódica, las más populares son las formas de período corto y período largo propuestas por el científico ruso.
Tabla de contenidos
Importancia y función
La tabla periódica de Mendeleev provocó una revolución en la química al clasificar los elementos de una manera más sistemática que los métodos de tipificación anteriores, un avance notable que simplificó su estudio. Esta representación se volvió útil para estudiar y comprender las propiedades de una gran cantidad de elementos de una manera más sencilla. Esto se debe a que los elementos que muestran propiedades similares pertenecen al mismo grupo.
La tabla periódica juega un papel muy importante en el desarrollo de la química y otras ciencias naturales. Gracias a ella, se descubrió la conexión mutua entre todos los elementos, así como sus propiedades físicas y químicas.
Después del descubrimiento de la Ley Periódica, sobre la que se fundamenta la tabla periódica, quedó claro que los átomos de todos los elementos deben construirse de acuerdo con un solo principio, y su estructura debe reflejar la periodicidad de las propiedades de los elementos.
Así, se convirtió en un eslabón importante en la evolución de la enseñanza atómico-molecular, teniendo un impacto significativo en el desarrollo de la teoría de la estructura del átomo. También contribuyó a la formulación del concepto moderno de “elemento químico" y la clarificación del concepto de sustancias simples y complejas.
La tabla periódica también ayudó a aclarar muchas de las características del comportamiento químico de elementos ya descubiertos. Los avances en física atómica, incluida la energía nuclear y la síntesis de elementos artificiales solo fueron posibles gracias a ella.
Concretamente, la tabla periódica permite, sin una investigación especial, conocer, e incluso predecir, las propiedades físicas y químicas (estado físico, dureza, color, valencia, ionización, estabilidad, metalicidad o no metalicidad, etc.) de un elemento solo sobre la base de las propiedades conocidas de los elementos adyacentes al grupo o período.
Elemento químico
Un elemento químico, frecuentemente llamado elemento, se define como un material que no puede descomponerse ni transformarse en otra sustancia por medios químicos y que está formado por átomos con un número idéntico de protones. Esencialmente, los elementos químicos son los componentes básicos de la materia.

Como bien precisó el químico Glenn T. Seaborg, pionero en el estudio de la síntesis de los nuevos elementos químicos y la primera persona viva en ser honrada con el nombre de un elemento químico en su honor: “Los elementos químicos son los componentes básicos de la naturaleza. Todas las sustancias que componen el mundo y el universo son combinaciones de estos elementos”.
Partes
En la tabla periódica, todos los elementos están ordenados según su número atómico, configuración electrónica y propiedades químicas repetitivas. Las filas de la tabla se denominan períodos y las columnas se denominan grupos. La primera tabla, fechada en 1869, contenía solo 60 elementos, pero ahora la tabla tuvo que ser ampliada para acomodar los 118 elementos conocidos en la actualidad.
En los grupos (columnas o filas verticales), los elementos se combinan de acuerdo con el estado de oxidación más alto en los óxidos. Cada grupo consta de un subgrupo principal y uno secundario. Los subgrupos principales incluyen elementos de períodos pequeños y elementos de períodos grandes con las mismas propiedades. Los subgrupos laterales constan solo de elementos de períodos grandes.
Clasificación de los elementos
La clasificación de los elementos químicos se basa en sus propiedades y en las propiedades de sus compuestos. La tabla periódica organiza los átomos según el número atómico creciente, de modo que los elementos con las mismas propiedades químicas se repiten periódicamente.
En general, en la tabla periódica hay 18 columnas verticales (18 grupos) y siete filas horizontales llamadas períodos (7 períodos).
En los períodos, los elementos están dispuestos en orden ascendente de acuerdo a los números ordinales (atómicos) de los elementos. De los siete, el primer, segundo y tercer período se llaman pequeños, y contienen 2, 8 y 8 elementos, respectivamente. Los períodos restantes se llaman grandes: en el cuarto y quinto períodos hay 18 elementos cada uno, en el sexto 32 y en el séptimo 31 elementos.
La clasificación periódica es el método por el cual se agrupan los elementos en función de sus características, es decir, manteniendo los elementos que son iguales en un grupo y el resto de elementos en el otro grupo.
Los elementos de los grupos 1, 2 y 13 a 17 se denominan elementos del grupo principal, también llamados elementos típicos, representativos o normales. Los elementos de los grupos 3 a 12 se denominan elementos de transición.
Grupos de los elementos
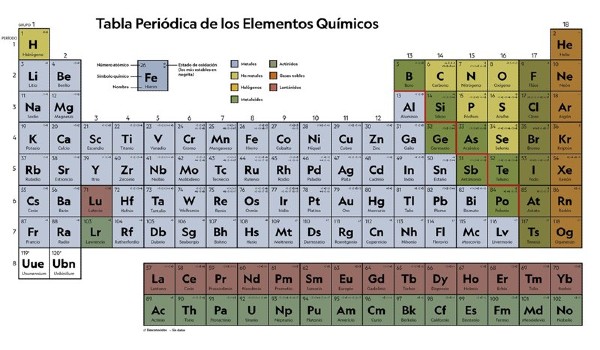
Por la posición de un elemento en el período, se puede determinar si pertenece a metales o no metales. Los metales se encuentran en la esquina inferior izquierda de la tabla, los no metales en la esquina superior derecha. Los semimetales están en el medio. Todos los períodos, excepto el primero, comienzan con un metal alcalino y termina con un gas inerte.
Metales alcalinos
El primer subgrupo del grupo principal de elementos son los metales alcalinos. Se trata de sustancias plateadas (excepto el cesio, que es dorado) tan blandas que se pueden cortar con un cuchillo. Dado que solo hay un electrón en su capa externa de electrones, reaccionan muy fácilmente.
La densidad de los metales alcalinos es menor que la densidad del agua, por lo que no se hunden en ella, sino que reaccionan violentamente con la formación de álcalis e hidrógeno. La reacción es tan vigorosa que el hidrógeno puede incluso encenderse o explotar. Estos metales reaccionan tan activamente con el oxígeno del aire que deben almacenarse bajo una capa de queroseno.
Metales alcalinotérreos
El segundo subgrupo, está representado por metales alcalinotérreos, los cuales se distinguen por tener dos electrones en el nivel de energía exterior del átomo. Estos elementos también tienen un tono plateado e interactúan fácilmente con otros elementos y su punto de fusión es más alto que el de los metales alcalinos.
Lantánidos y actínidos
En el tercer grupo, el subgrupo lateral de los períodos sexto y séptimo, hay varios metales que son similares en estructura al nivel de energía externa y tienen propiedades químicas cercanas. En estos elementos, llamados lantánidos y actínidos, los electrones comienzan a llenar el tercer nivel desde la capa externa de electrones.
Los lantánidos a veces se denominan "elementos de tierras raras", ya que se encuentran en pequeñas cantidades en la composición de los minerales raros. Los actínidos tienen una característica común importante: la radiactividad. Además, con la excepción del uranio, los actínidos prácticamente no se encuentran en la naturaleza, por lo que se sintetizan artificialmente.
Metales de transición
Los elementos de los subgrupos laterales, excepto los lantánidos y actínidos, se denominan metales de transición. Estos elementos encajan bien con el criterio habitual sobre los metales: son sólidos (con la excepción del mercurio que es líquido), densos, tienen un brillo característico, conducen bien el calor y la electricidad.
La particularidad que distingue a los metales de transición es que los electrones de valencia de sus átomos se encuentran en los niveles de energía externos y preexternos.
No metales
La esquina superior derecha de la tabla está ocupada por los no metales. Estos elementos son malos conductores de calor y electricidad, y pueden existir en tres estados: sólidos (como el carbono o el silicio), líquidos (como el bromo) y gaseosos (como el oxígeno y el nitrógeno). El hidrógeno puede exhibir propiedades tanto metálicas como no metálicas, por lo que se refiere tanto al primer como al séptimo grupo de la tabla periódica.
Gases inertes
Los gases inertes, dispuestos en el octavo subgrupo del grupo principal, son elementos con un nivel de electrones externos completamente lleno. Prácticamente son incapaces de participar en reacciones químicas, propiedad por la que a veces se les llama "nobles", trazando un paralelismo con los representantes de la alta sociedad, que desdeñan contactar con los forasteros.
Los gases inertes tienen una capacidad asombrosa: brillan bajo la influencia de la radiación electromagnética, por eso se utilizan para crear lámparas. Por ejemplo, el neón se usa para crear letreros luminosos y anuncios, y el xenón se usa en los faros y linternas de los automóviles.
El helio tiene una masa de solo el doble de la masa de una molécula de hidrógeno, pero, a diferencia de esta última, no es explosivo y se utiliza para llenar globos.
Historia de la tabla periódica de los elementos

A mediados del siglo XIX, los científicos tenían mucha información sobre las propiedades físicas y químicas de varios elementos y sus compuestos, creando la necesidad de organizar este conocimiento y presentarlo de forma visual.
Investigadores de diferentes países intentaron crear una clasificación, combinando elementos según la similitud de la composición y las propiedades de las sustancias que forman; sin embargo, ninguno de los sistemas propuestos cubría todos los elementos conocidos.
Fue entonces cuando el profesor ruso Dmitri Ivanovich Mendeleev recopiló y clasificó información sobre las propiedades de los elementos y sus compuestos, y luego la refinó en el curso de numerosos experimentos.
Después de recopilar los datos, escribió información sobre cada elemento en tarjetas, las colocó sobre una mesa y las movió muchas veces, tratando de construir un sistema lógico.
Una larga investigación científica lo llevó a concluir que las propiedades de los elementos y sus compuestos cambian con el aumento de la masa atómica, pero no de manera monótona, sino periódicamente.
Así se descubrió la Ley Periódica, que el científico formuló de la siguiente manera: "Las propiedades de los elementos, por tanto, las propiedades de los cuerpos simples y complejos formados por ellos, dependen periódicamente de su peso atómico".
Mendeleev ilustró este principio en una tabla en la que se presentaron los 63 elementos químicos conocidos en ese momento. Al crearlo, el científico tomó una serie de pasos muy audaces.
Primero, numerosos experimentos permitieron a Mendeleev concluir que las masas atómicas de algunos elementos se habían calculado previamente de manera incorrecta, y las cambió de acuerdo con su sistema. En segundo lugar, se dejó espacio en la tabla para nuevos elementos, cuyo descubrimiento predijo el científico, describiendo en detalle sus propiedades.
La comunidad científica mundial se mostró inicialmente escéptica sobre el descubrimiento del químico ruso. Sin embargo, pronto se descubrieron los elementos químicos predichos por él: galio, escandio y germanio, lo que desvaneció las dudas existentes sobre la tabla periódica de Mendeleev.
La tabla periódica de los elementos químicos es, sin lugar a dudas, el sistema natural de clasificación más fundamental jamás ideado y representa el triunfo de uno de los grandes temas organizativos de la ciencia.
Referencias
- National Geographic España.-. La tabla periódica, la forma de ordenar los elementos químicos. website: https://www.nationalgeographic.com.es/ciencia/tabla-periodica-forma-ordenar-elementos-quimicos_15988