Sodio

El sodio es un elemento químico categorizado como metal alcalino, ubicado en el grupo 1 de la tabla periódica. Su número atómico es el 11, su masa atómica es de 22,9898 unidades y es representado por el símbolo química Na.
Es el sexto elemento más abundante en la corteza terrestre, comprendiendo un 2,6% de esta. En condiciones naturales constituye minerales como la halita (sal común), thernarlita, natrón, zeolita, entre otros.
Fue descubierto en el año 1807 por el químico británico Humpry Davy, sin embargo, no fue sino 7 años después, cuando Jons Jakom difundió el uso simbólico de Na para este nuevo elemento.
Tabla de contenidos
Características y propiedades
- El sodio es un metal alcalino con una gran reactividad, por ello es imposible encontrarlo en estado puro en la naturaleza.
- Este elemento reacciona con oxígeno, nitrógeno, cloro, carbono y silicio para formar minerales.
- El mineral más abundante del sodio es la halita o sal común.
- Es parte esencial de la estructura iónica del agua marina y oceánica.
- Cuando el sodio se oxida puede entrar en combustión espontánea de manera explosiva, produciendo una llama amarillenta.
Los líderes mundiales en producción de sodio puro son compañías de Francia y Estados Unidos. Sin embargo, China es el país con mayor producción de sal común, seguida de Estados Unidos, India, Alemania y Canadá.
Propiedades físicas
- En condiciones atmosféricas promedio, es decir, ambientes con 20°C de temperatura y con una presión atmosférica igual a 1 atm, el estado de agregación del sodio es sólido.
- Su temperatura de fusión es de 98°C.
- Su temperatura de ebullición es de 883°C.
- En estado sólido, y a una temperatura de 20 °C, tiene una densidad de 968 kg/m3.
- En estado sólido presenta una estructura cristalina cúbica centrada en el cuerpo.
- Organolépticamente, es un metal blando, con tonalidades plateadas que se tornan grisáceas cuando interactúa con el aire.
- Tiene buena conductividad eléctrica y térmica, ya que solo permite un único electrón en su nivel más energético.
- Es un metal paramagnético.
- Su estado de agregación ordinario es el sólido.
- En combustión emite fotones cuya longitud de onda es igual a 589,3nm, lo que corresponde a la línea espectral D. Por esto, la flama de su combustión es de color amarillo.
- Presenta una dureza de 1,2 en la escala de Mohs.
Propiedades químicas
- Atómicamente, el sodio se compone de 11 protones, 11 electrones y 12 neutrones.
- Es un elemento monovalente.
- El sodio es capaz de producir explosiones violentas cuando reacciona con disoluciones acuosas (agua, fluoruro de hidrógeno, ácido sulfúrico y cloruro de hidrógeno, etc.).
- Al reaccionar con agua libera hidrógeno, hidróxido de sodio y calor.
- Los minerales de sodio por lo general están cubiertos por una capa de óxido, cloruro o carbonato; según sea la composición del entorno.
- El catión Na+ es el componente biológico que mantiene la osmolaridad y el volumen de fluidos extracelulares como la sangre.
Usos

Probablemente el uso más conocido del sodio sea el dado por la industria alimenticia, ya que forma parte de la estructura molecular de la sal común y otros productos utilizados para sazonar diversas comidas.
El sector metalúrgico usa el sodio como desoxidante y reductor en los procesos de purificación de metales como el zirconio, titanio, entre otros. Además, es empleado para generar aleaciones antifricción.
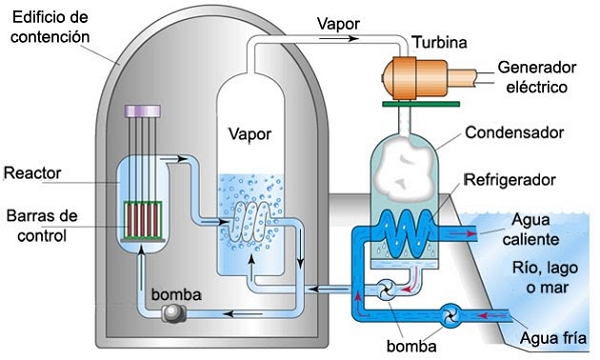
El sodio fundido es usado como agente refrigerante en los reactores nucleares, debido a que permite transferir calor gracias a su alta conductividad.
Las sales de sodio son necesarias para fabricar productos de la higiene personal (jabones, detergentes y desodorantes). Mientras que compuestos como el fluoruro de sodio son empleados como antisépticos, y aquellos como el nitrato de sodio sirven como fertilizantes.
El sodio también interviene en la tecnología moderna, puesto que es un componente de las células fotoeléctricas. Y desde hace años, el vapor de sodio es usado para la iluminación.
Dónde se encuentra

El sodio es considerado el sexto elemento con mayor presencia en la masa planetaria con el 2, 6% y conforma el 80% de todos los elementos disueltos en el mar.
Los principales países donde se encuentra el sodio son China, Estados Unidos y la India, quienes se encargan de la distribución y el comercio de sodio internacional.
El sodio se encuentra con facilidad en el océano de manera iónica, en el metabolismo celular, sales marinas y en la composición de un mineral denominado halita.
Un estudio realizado por entidades dedicadas al estudio del espacio, resaltó que las estrellas son fuentes primordiales en la obtención de sodio.
Obtención
Al igual que otros elementos, la obtención del sodio depende de la electrólisis con cloruro sódico fundido, también denominado como el proceso Downs.

Para obtener cantidades de sodio se necesitan seguir estos pasos:
- El cloruro de sodio debe ser sometido a puntos de fusión que sobrepasen los 800°C.
- Añadir el carbonato sódico o el cloruro de calcio.
- Tras unos minutos, descender la temperatura a 600°C.
- Esperar que las reacciones de separación entre el sodio y otros elementos culminen.
- Extraer el sodio resultante y dejarlo reposar durante unas horas.
- Luego, colocar el sodio en la actividad que va a desempeñar.
Este es el procedimiento de extracción más económico, debido a que el utilizado con hidróxido de sodio (proceso Castner – Kellner) es un poco costoso industrialmente.
Además, el cloruro sódico es producido con instrumentos similares en la que es fabricada la sal común en países como Estados Unidos.
Quién lo descubrió
El sodio ha sido utilizado desde la antigüedad, especialmente en su forma más primitiva como lo es la sal común o el carbonato de sodio.

Los primeros avistamientos científicos fueron para la década de los 1800, cuando Sir Humphrey Davy aisló unos gramos de sodio a través de la electrólisis con la ayuda de hidróxido de sodio.
En este mismo momento, el científico practicó los mismos procesos con el potasio, el calcio y otros elementos para observar sus reacciones químicas.
Pero fue en 1814, cuando el científico Jöns Jakob acuñó la simbología Na para referirse a “natrium” que significa sodio, fue integrada al Sistema de Símbolos Químicos de la época.
Luego, con el pasar de los años, el sodio probó ser un gran complemento para colorantes, fabricación de lámparas de vapor, detergentes, lociones y elaboración de plomo tetrástilo.
También se obtienen otros productos de gran valor como blanqueadores para la piel, cremas para los dolores, papeleras y oxidantes para la industria textil.
Mientras que el fluoruro de sodio (NaF) se utiliza como insecticida de ratones y antiséptico para las heridas, el nitrato de sodio se encuentra desempeñando actividades como fertilizante.