Modelo atómico
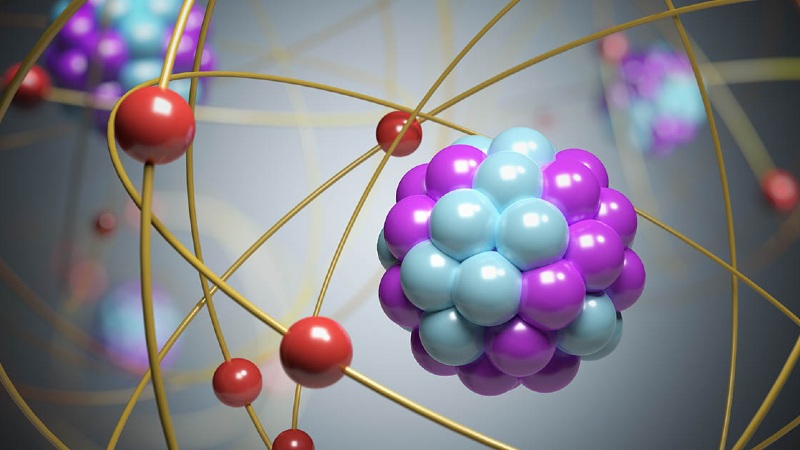
Se entiende por modelo atómico a la representación teórica que describe la estructura de los átomos sobre la base de las propiedades observables de la materia y datos determinados experimentalmente.
La necesidad de utilizar modelos atómicos se debe al hecho de que, a pesar de los avances y descubrimientos en física atómica, aún no se cuenta con una teoría coherente, exacta y rigurosa de la conformación y estructura del átomo.
Esto se debe al hecho de que los átomos son sistemas compuestos de un número importante (decenas, centenas) de partículas llamadas nucleones (protones y neutrones) ubicadas cerca unas de otras y que interactúan fuertemente entre sí y con los electrones. Por lo tanto, la descripción teórica de los átomos plantea una tarea desafiante y compleja.
Si bien la conciencia de la existencia del átomo se remonta a la antigua Grecia y la concepción del átomo de Demócrito, no fue sino a principios del siglo XIX que los científicos profundizaron en la composición y estructura del átomo lo que provocó en surgimiento de los modelos atómicos.
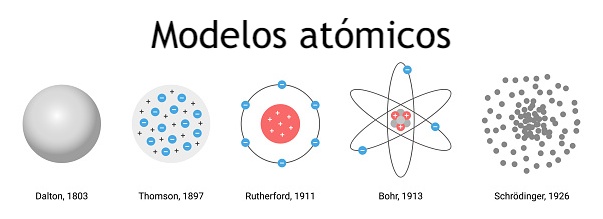
A lo largo de la historia de la física atómica, se ha planteado una gran variedad de teorías. Existen cinco modelos atómicos básicos los cuales contribuyeron decisivamente a establecer la forma en que se percibe la estructura del átomo en sí, sirven de precursores para el modelo final del átomo que se utiliza hoy en día y que se acepta como el más preciso. Estos modelos son:
- El modelo de bola de billar de Dalton.
- El modelo del “pudín de ciruela” de Thomson.
- El modelo planetario de Rutherford.
- El modelo atómico de Bohr.
- El modelo de nube de electrones o modelo atómico mecánico cuántico de Schrödinger.
Tabla de contenidos
Diferencias entre los modelos atómicos
El modelo de bola de billar de Dalton se distingue por 2 postulados: (1) los átomos reconocidos de un elemento concreto se diferencian de otros elementos; (2) los átomos no son indivisibles, sino que están compuestos por partículas subatómicas.
Esto difiere del modelo del “pudín de ciruela” de Thomson, ya que considera que los átomos no son esferas sólidas indivisibles, sino que estas esferas de carga positiva, contenían electrones de carga negativa.
Esta imagen contrasta con el modelo atómico propuesto por Rutherford, el cual distingue un núcleo de carga positiva y electrones de carga negativa orbitando a su alrededor, de modo similar a los planetas del sistema solar, por lo que se llamó el modelo planetario.
En respuesta a algunas contradicciones del modelo planetario, el modelo atómico de Bohr planteó órbitas de electrones estables y propuso que cuando los electrones se mueven a lo largo de órbitas estacionarias, no emiten ni absorbe energía, lo que desafió las leyes de la física clásica.
Sobre la base de este postulado, el modelo de nube de electrones o modelo atómico mecánico cuántico de Schrödinger, muestra que los electrones no se mueven alrededor del núcleo en órbitas, sino en “nubes” donde su posición es incierta. En la actualidad, esta representación teórica es ampliamente aceptada como el modelo más preciso del átomo.
Cronología del modelo atómico
En 1803, el químico, físico y meteorólogo inglés John Dalton, básicamente amplió la idea griega del átomo, lo que se reconoce como el primer intento completo de describir toda la materia en términos de partículas. Bajo esta perspectiva, este científico afirmó que:
- Toda la materia está hecha de átomos y que estos son indivisibles e indestructibles.
- Todos los átomos de un elemento dado son idénticos en masa y propiedades.
- Los compuestos están formados por una combinación de dos o más tipos diferentes de átomos.

El principal argumento contra la teoría de Dalton se fundamentó principalmente en que la carga eléctrica de los átomos presupone su divisibilidad. En general, el modelo de bola de billar de Dalton suponía que los átomos eran esferas sólidas, una creencia que cambió cuando el físico inglés Joseph John Thomson descubrió el electrón en 1897.
Modelo de pudín de ciruela
Fundamentado en este descubrimiento, en el año 1904, Thomson propuso un modelo atómico, conocido como el modelo “pudín” de la estructura del átomo, el cual consideraba al átomo como una “bola” dentro de la cual se distribuía una carga positiva por todo el volumen (el “pudín” en sí mismo) y se ubicaban electrones cargados negativamente (las “pasas” en el pudín).

Modelo planetario
Este modelo contrastó con la propuesta planteada por el físico británico-neozelandés Ernest Rutherford, quien en 1911 sugirió que en el centro del átomo hay un núcleo, en el que se concentra toda la carga positiva y prácticamente toda la masa del átomo, y que alrededor de ese núcleo giran electrones cargados negativamente, de forma similar a como los planetas orbitan el sol, un paralelismo por el que la propuesta se conoció como el modelo planetario de Rutherford.
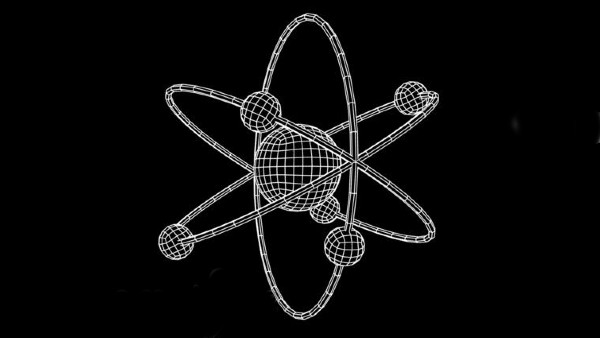
Sin embargo, el modelo planetario pronto reveló algunas contradicciones. La más relevante se enfocó en la teoría electromagnética, por la cual, los electrones moviéndose alrededor del núcleo con aceleración debían irradiar energía continuamente, lo que conduciría a su caída (colapso) sobre el núcleo. Pero no se ha encontrado evidencia de este comportamiento de los electrones.
Modelo de Bohr del átomo
Esta contradicción fue explicada por el físico danés Neils Bohr, quien en 1913 propuso, sin negar el movimiento de los electrones alrededor del núcleo planteado por Rutherford, dos postulados: (1) un electrón puede girar alrededor de un núcleo no en órbitas circulares arbitrarias, sino solo en órbitas circulares estrictamente definidas y (2) cuando se mueve a lo largo de órbitas estacionarias, el electrón no emite ni absorbe energía.
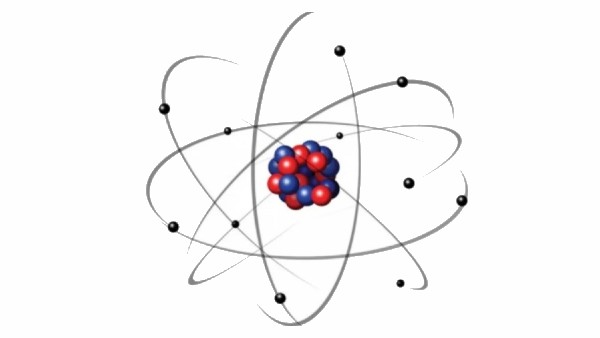
De acuerdo al planteamiento de Bohr, la emisión o absorción de energía por parte de un electrón ocurre solo durante su transición de una órbita estacionaria a otra. Este planteamiento fue la causa de un gran debate entre la comunidad científica pues implica que el electrón del átomo no obedece las leyes de la física clásica.
En los años siguientes, la teoría de Bohr se replanteó y complementó parcialmente. Se introdujo el concepto de la naturaleza dual del electrón, el cual presenta propiedades tanto de una partícula como de una onda. La teoría de Bohr fue reemplazada por la teoría cuántica de Schrödinger, que tiene en cuenta las propiedades ondulatorias del electrón y otras partículas elementales que forman el átomo.
Modelo atómico mecánico cuántico
En este punto, muchos científicos estaban investigando y tratando de desarrollar el modelo cuántico del átomo. El principal de ellos fue el físico austriaco Erwin Schrödinger, quien en 1926 propuso que, en lugar de que los electrones se mueven en órbitas o capas fijas, se comportan como tanto como partículas como ondas, lo que se conoce como dualidad onda-partícula.

Schrödinger resolvió una serie de ecuaciones matemáticas para llegar a un modelo que explique las distribuciones de electrones en un átomo, el cual muestra el núcleo del átomo rodeado por nubes de densidad electrónica.
Estas nubes son nubes de probabilidad; aunque no se puede determinar exactamente dónde están los electrones, se sabe la probabilidad de que se encuentren en determinadas regiones del espacio, llamadas orbitales de electrones. Este modelo atómico presentado por Schrödinger se conoce como el modelo de nube de electrones o modelo atómico mecánico cuántico.
Desde entonces, los físicos han descubierto que los protones y neutrones que forman el núcleo son en sí mismos divisibles en partículas llamadas quarks, y estos están constituidos a su vez por cuerdas energéticas, completando la imagen actual de las partículas subatómicas que componen un átomo, y esclareciendo teóricamente su estructura.
Referencias
- Páez, I. (2004). Los Modelos Atómicos desde la perspectiva de la historia y filosofía de la ciencia: un análisis de la imagen reflejada por los textos de química de bachillerato, de ve.scielo.org website: http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S1316-00872004000100004