Metales

Los metales son cuerpos simples de consistencia generalmente sólida a temperatura ambiente y presión atmosférica normal, siendo muy conocidos por su excelente capacidad para conducir electricidad y calor. Por lo general poseen un brillo característico.
La gran mayoría de los metales posee alta maleabilidad, por lo que son utilizados en la fabricación de objetos, incluso en aleación con otros metales, para aprovechar las características que cada uno puede ofrecer en conjunto.
Para la Química se puede definir a los metales como elementos químicos capaces de conducir calor y electricidad, a temperatura ambiente se encuentran en estado sólido a excepción del mercurio que se encuentra en estado líquido, además de esto son maleables, es decir, se los puede dar forma y poseen cierto brillo característico.
La Tabla Periódica de los elementos está conformada en su mayoría por metales. Estos son elementos puros, pero es conveniente saber que también se conoce como metales a las aleaciones que tienen características metálicas. Tal es el caso del Bronce, el cual es una aleación de Estaño con Cobre.
Tabla de contenidos
Características y propiedades

Las características de los metales pueden variar de acuerdo a su posición en la tabla periódica. Sin embargo, ya hemos notado que son muy conocidos por los siguientes detalles propios:
- Son excelentes conductores de electricidad y calor.
- Son maleables y dúctiles.
- Algunos son muy duros, aunque esto puede variar hasta darse el caso del mercurio, el cual es líquido a temperatura ambiente.
- Tienen alta densidad.
- A excepción del mercurio, todos los metales son sólidos.
- Algunos son brillantes, pero otros son opacos.
- La mayoría son grisáceos, aunque algunos presentan colores rojizos, rosáceos, amarillo y policromáticos.
Propiedades físicas
- Conductividad: son buenos conductores de electricidad. Permiten fácilmente el flujo de electrones a través de ellos.
- Ductilidad: se pueden alargar lo suficiente, por medio de la aplicación de una fuerza de tracción, hasta convertirse en hilo metálico o alambre.
- Maleabilidad: si se les somete a compresión, se pueden fabricar láminas metálicas. Esto puede verse en la siderurgia y la orfebrería.
- Resistencia mecánica: poseen una alta resistencia natural a ser deformados o rotos si se les somete a torsión, flexión, compresión o tracción. Algunos pueden tener más resistencia mecánica que otros.
- Tenacidad: esta es la propiedad física que les permite tener gran resistencia a deformarse en caso de que reciban golpes o cualquier tipo de fuerzas bruscas.
Propiedades químicas
- Pueden formar mezclas entre sí, conocidas como aleaciones.
- Son monoatómicos, es decir, sus moléculas las conforman un único átomo.
- En contacto con el oxígeno, reaccionan en forma de óxido. Sus energías de ionización tienden a ser bajas.
- Los átomos de los metales pueden poseer 1, 2 o 3 electrones en el último nivel de energía (valencia), dependiendo del elemento atómico. Esto permite que puedan ceder electrones fácilmente, formando cationes. Esto hace que sean buenos agentes reductores.
- Ceden electrones con facilidad, pero es muy difícil que los acepten de otros elementos.
- Pueden reaccionar químicamente con ácidos, formando sales y agua.
- Tienen la propiedad de formar óxidos básicos.
Propiedades mecánicas
Las propiedades mecánicas de los metales tienen mucho en común con sus propiedades físicas, aunque más enfocado a la ciencia de Resistencia de los Materiales. Entre estas propiedades podemos nombrar las siguientes:
- Tenacidad: es la capacidad que tiene un metal de resistir una fuerza externa sin llegar a romperse.
- Fragilidad: es lo opuesto a la Tenacidad, y puede decirse que es la facilidad con la que un metal llega a romperse al ser sometido a fuerzas o esfuerzos externos. Esto se le conoce como fatiga, al ser sometido a las pruebas realizadas, para comprobar la resistencia mecánica de un metal.
- Plasticidad: es la capacidad de mantener su forma luego de que esta haya sido cambiada a través de fuerzas externas. Los metales son muy plásticos
- Elasticidad: se refiere a la capacidad de recuperar la forma anterior a la modificación o aplicación de fuerzas. Los metales son poco elásticos, por lo que es muy difícil que recuperen su forma anterior. Es lo contrario a la Plasticidad.
- Maleabilidad: es la capacidad que tiene un metal de ser laminado sin que se rompa o pierda sus propiedades originales.
- Dureza: esta es la propiedad que permite al metal no ser penetrado o rayado por algún tipo de fuerza externa, oponiendo resistencia a cualquier elemento abrasivo, impidiendo de esta manera los daños mecánicos.
- Ductilidad: es la capacidad de deformación que posee un metal hasta llegar al punto de ruptura.
- Rigidez: cuando un metal es sometido a una fuerza externa, este reacciona según la Tercera Ley de Newton con una fuerza interna llamada "estrés". Entonces la rigidez es la capacidad de resistencia del metal a deformarse ante la influencia del "estrés".
- Variabilidad de las propiedades: durante los experimentos para probar las propiedades mecánicas de los metales, pueden surgir divergencias en las medidas resultantes, que pueden deberse a diversos factores.
Tipos o clasificación

Existen varias formas de clasificación de los metales. Desde el punto de vista de la minería los minerales se pueden dividir en Metálicos y No Metálicos. Veamos a continuación los Tipos de metales, según clasificaciones de tipo general (tomando en cuenta a la industria de la minería) y las que se basan en la Tabla Periódica de los elementos.
Tipos de metales según la tabla periódica
En la Tabla Periódica podemos ver los tipos de metales separados por Grupos con propiedades afines. Estos grupos son:
Metales de transición
Ocupan la parte central de la Tabla Periódica (el denominado Grupo D) y los conforman la mayor parte de los metales conocidos. Por lo general su dureza y puntos de fusión son elevados. Tienen alta conductividad eléctrica.
Metales alcalinos
Son los 6 metales que están en el Grupo I de la Tabla Periódica (Francio, Cesio, Rubidio, Potasio, Sodio y Litio). En condiciones normales de presión y temperatura tienden a ser altamente reactivos desde el punto de vista químico. Son blandos y brillantes. Jamás se encuentran en estado puro en el medio ambiente natural. Conducen bien la electricidad y el calor y poseen bajas densidades.
Metales alcalinotérreos
Están conformados por 6 metales ubicados en el Grupo II de la Tabla Periódica (Bario, Estroncio, Calcio, Magnesio, Berilio y Radio. Este último no cuenta mucho para efectos prácticos como metal, ya que su duración promedio es muy corta). Su dureza es mayor con respecto a los metales alcalinos, aunque su reactividad química es menor. Poseen baja densidad, buena conductividad y su superficie es brillante.
Lantánidos
Son parte del conjunto de elementos químicos que conforman las "Tierras Raras" en la Tabla Periódica. También se les conoce como lantanoides, y se encuentran ubicados en el periodo VI (6) del sistema periódico. Junto a los Actínidos, conforman los “elementos de transición interna”. No son tan raros como su nombre sugiere, ya que se consiguen en abundancia en el mundo natural. Están comprendidos entre los números atómico 57 y 71. Entre ellos podemos nombrar el Lantano, Gadolinio, Erbio y el Praseodimio.
Actínidos (actinoides)
Forman parte de las Tierras Raras y conforman parte de los "Elementos de Transición Interna". Son metales radioactivos y pesados, cuyos números atómicos están comprendidos entre el 89 y el 103. Son muy raros en la naturaleza. Ejemplos de ello son el Uranio, el Actinio y el Neptunio.
Transactínidos
Estos son los elementos "superpesados" que se encuentran en el bloque d de la Tabla Periódica. También son transuránicos, ya que su número atómico supera al del Uranio, que es un actínido. Casi todos, excepto el Dubnio, poseen tiempos de desintegración extremadamente cortos, por lo que solo pueden ser vistos en laboratorios.
Tipos de metales según la minería
Existen cuatro tipos de elementos metálicos (minería metálica), los cuales son los siguientes:
- Ferrosos: en su estado natural tienen mucha presencia de hierro tales como el propio Hierro, Cromo, Titanio, Tungsteno, Cobalto, Molibdeno y Manganeso.
- Básicos: entre los que se hallan el Estaño, Zinc, Plomo y Cobre. Se caracterizan por ser activos desde el punto de vista químico.
- Radioactivos: como el Torio, Radio, Uranio y Plutonio. Son bastante escasos en la naturaleza.
- Preciosos: están los muy conocidos como el Oro, el Platino y la Plata.
- Podemos clasificar los metales en Ferrosos y No Ferrosos.
- Otra forma de clasificar a los metales es en Metales negros y Metales de color.
Resumen del tipo de metales
- Metales alcalinos: están el Grupo I de la Tabla Periódica y forman una serie química.
- Metales alcalinotérreos: conforman el Grupo II de la Tabla Periódica y son muy reactivos.
- Metales de transición: están en el Grupo D, y su orbital D está lleno parcialmente de electrones.
- Metales de transición interna: son los lantánidos y los actínidos. Están en el bloque f y sus electrones de valencia se encuentran en el orbital f.
- Metales ferrosos: los conforman el Hierro puro y sus aleaciones.
- Metales no ferrosos: son aquellos que no poseen Hierro en cantidades significativas. El Cobre y el Aluminio son buenos ejemplos de ellos.
- Metales nobles: son aquellos de poca reactividad química, lo cual los hace poco susceptibles a la corrosión. También se les conoce como metales del grupo platino, entre los que se encuentran el Platino, Rutenio, Osmio, Iridio, Paladio y Rodio. Son muy usados para fines tecnológicos y en joyería.
- Metales preciosos: son aquellos que no forman compuestos de manera natural con otros metales, por lo que se hallan libres en la naturaleza. Entre ellos tenemos el Oro, la Plata y todos los metales Nobles.
- Metales pesados: este es un concepto sobre el cual no hay un consenso en su definición, pero en resumen podemos decir que son aquellos que contaminan el medio natural, envenenándolo y siendo muy difíciles de remover. Entre ellos están los lantánidos, actínidos, algunos semimetales y los metales de transición.
Obtención

Los metales se encuentran en abundancia en la naturaleza, pero hallarlos en estado puro no es sencillo, salvo pequeñas excepciones.
En la antigüedad era posible encontrar oro, plata y cobre en forma casi pura, en estado natural, pero hoy en día es necesario aplicar métodos de extracción artesanales o industriales para obtener estos elementos.
El hierro es el segundo metal más abundante después del aluminio, pero casi nunca se consigue en estado puro. En la naturaleza es común conseguirlo en forma de hematita, magnetita, pirita, óxido férrico entre otros. Para extraerlo hay que aplicar métodos de reducción en un tipo de horno denominado Alto Horno.
Al igual que el hierro, muchos otros metales se consiguen en forma de óxidos al reaccionar con el oxígeno. De estas minas de óxidos podemos extraer otros minerales como el aluminio.
Otra mena de metales los constituyen los sulfuros, tales como el sulfuro de cobre, los cuales son bastante comunes. Los depósitos de cloruro nos sirven para extraer metales alcalinos, mientras que de las minas de carbonatos insolubles es posible obtener algunos metales alcalinotérreos, además del bario, el estroncio y el calcio.
Finalmente, las sales de fosfatos son la fuente para extraer los metales actínidos y lantánidos.
Usos y aplicaciones
Desde la antigüedad, los metales han tenido usos y aplicaciones que van desde el simple uso ornamental hasta cambiar el curso de la historia. Su importancia y aportes al desarrollo de la humanidad es simplemente enorme. En la actualidad podemos nombrar algunos de sus usos:

- Se usan en la industria automotriz y transporte en general, ya sea para fabricar autos, aviones, trenes, repuestos, etc.
- En la industria de la construcción se usan para el concreto armado, estructuras metálicas, construcción de puentes y todo tipo de infraestructuras para uso civil y militar.
- Se fabrican herramientas, máquinas, armas, utensilios y diversos artefactos destinados a la mejora de la calidad de vida de los individuos y la sociedad en general. Podemos ver muestras de ellos en la medicina, computación, telefonía, comunicaciones y desarrollos de vanguardia.
- El cloruro de potasio y el nitrato de sodio se usan como fertilizantes a nivel mundial, logrando aumentar la producción de alimentos.
- Los cristales se fabrican con carbonato potásico.
- Para fabricar pólvora se utiliza nitrato.
- El litio es esencial para las pilas de los celulares y muchos otros usos en la industria y la medicina.
- Las líneas de electricidad de cobre y aluminio, son imprescindibles para transportar energía eléctrica.
- Pequeños circuitos eléctricos son fabricados con oro y otros metales preciosos, por su buena conductividad y poca oxidación.
Nota: el ser humano necesita algunos minerales en su alimentación, los cuales se denominan oligoelementos. Su falta o exceso puede ser muy dañino para la salud.
El color rojo de la sangre se debe al Hierro de la hemoglobina, la cual tiene una enorme importancia en la oxigenación del cuerpo.
Tabla periódica
Esta es una representación en forma de tabla de todos los elemento químicos conocidos hasta ahora. Los elementos atómicos están clasificados según su número atómico. La tabla muestra además, las propiedades químicas de los elementos y su configuración de protones.
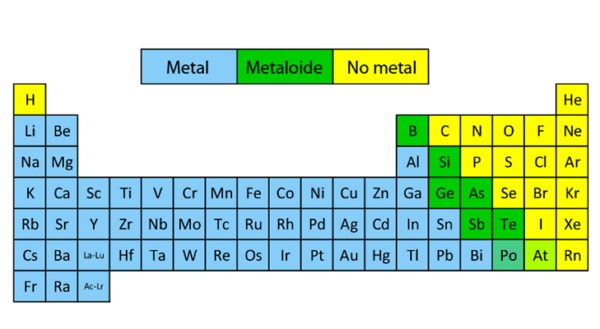
Esta tabla es muy útil para la química. Su estructura consiste en colocar los elementos en Grupos y Periodos. También se suele dividir a la tabla en Bloques.
De acuerdo a las propiedades químicas y físicas que comparten los elementos, se aceptan 3 grandes categorías que son los metales, metaloides y no metales.
Diferencias entre metales y no metales
- Los metales son buenos conductores de calor y electricidad, mientras que los no metales son malos conductores.
- Los metales tienden a ser brillantes mientras que los no metales son opacos.
- Los metales poseen baja energía de ionización y baja electronegatividad mientras que los no metales son lo contrario.
- Los metales suelen duros y sonoros, mientras que los no metales no poseen estas características.
- Los metales son buenos agentes reductores, mientras que los no metales son buenos agentes oxidantes.
- Los metales son sólidos (excepto el mercurio), mientras que los no metales pueden ser sólidos, líquidos o gaseosos.
Ejemplos
- Metales: hierro, oro, zinc, aluminio, cobre, aleaciones, etc.
- No metales: hidrógeno, oxígeno, carbono, nitrógeno, fósforo, azufre, cloro, yodo, selenio, etc.
Historia

La humanidad ha estado unida de alguna forma a los metales desde tiempos prehistóricos. Es posible que al hombre primitivo le haya atraído el brillo de algunos de estos elementos que se podían encontrar en estado puro, tales como el cobre, la plata y el oro.
Esta simple atracción, seguramente les permitió empezar a moldear los primeros objetos ornamentales, los cuales eran hechos a mano. Luego se dieron cuenta de que podían fabricar herramientas, incluyendo armas con las cuales podían defenderse y salir a cazar.
Uno de los grandes hitos de la humanidad fue el descubrimiento del Bronce, que dio pie a la llamada Edad del Bronce la cual se establece entre el año 3.500 a.C. y el año 2.000 a.C., sucediendo a la Edad de Piedra.
En el año 1.400 a.C., la civilización Hitita comenzó a utilizar el hierro comenzando de esta manera con la denominada Edad del Hierro, lo que permitió fabricar armas más fuertes que les daban ventaja militar, aunque los egipcios adoptaron rápidamente esta tecnología.
La falta de hornos potentes impidió qué el hombre siguiera experimentando con los metales, y no fue sino hasta el año 1.400 de nuestra era que se pudieron implementar hornos que podían alcanzar los 1.538 grados centígrados, la cual es la temperatura de fusión del hierro.
El mérito de producir acero se lo debemos a Henry Bessemer, el cual es considerado el pionero de la siderurgia moderna. Henry diseñó un horno llamado "el convertidor Thomas-Bessemer", con el cual se podía fabricar lingotes de acero en serie, dejando al hierro como un elemento secundario.
La entrada del magnesio y aluminio llegó poco después, lo cual fue un avance decisivo que permitió desarrollar aleaciones más livianas y resistentes, lo cual fue decisivo para el desarrollo de la Aviación, fabricación de diversas herramientas portátiles y muchos avances tecnológicos más.
En la actualidad el titanio se ha convertido en uno de los metales más utilizados en la industria por sus características de ser un metal poderoso y liviano.
Hoy en día podemos contar con diversos tipos de metales, los cuales son muy importantes en el desarrollo de la economía mundial, incluyendo los metales ferrosos, metales no ferrosos, metales preciosos, metales pesados, etc.