Leyes de la termodinámica

Las leyes de la termodinámica, también conocidas como principios de la termodinámica, explican el comportamiento de los elementos físicos de temperatura, entropía y energía en los sistemas termodinámicos.
Mediante su estudio, se pueden ver todas sus propiedades de un sistema a gran escala, sin atender a sus componentes más pequeños. No importa si se trata de una molécula o de elementos más complejos como, por ejemplo, la atmósfera.
Existen cuatro principios de la termodinámica, los cuales surgen a raíz de la comprensión del hombre de que todo sistema es, en sí mismo, una entidad.
Los principios termodinámicos se expresan mediante ecuaciones matemáticas y también sirven para reconocer la interacción de las leyes universales y la inexistencia de algunos fenómenos como, por ejemplo, el de movimiento perpetuo.
Tabla de contenidos
Principio cero de la termodinámica: equilibrio térmico
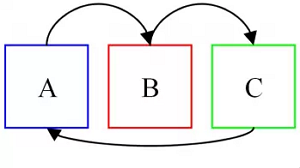
Es una ley que también se define como “ley del equilibrio térmico”. Ella explica la correspondencia equilibrada que se genera por la interrelación directa e indirecta entre la temperatura de cada uno de sus elementos.
Es decir, establece que si un cuerpo A está en equilibrio con un cuerpo B y este, a su vez, está en equilibrio con un cuerpo C, ocurre un equilibrio total de la temperatura entre esos tres cuerpos.
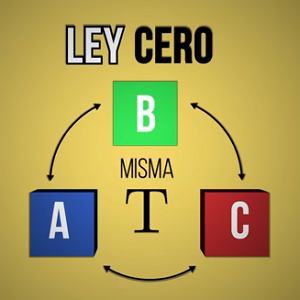
Una manera fácil de entender sus postulados es que si distintos elementos con diferentes temperaturas se ponen en contacto entre sí, su calor se intercambia hasta llegar a equilibrarse en cada uno de los componentes de ese sistema.
Por ejemplo, cuando se entra de una habitación fría a una caliente, al poco tiempo el cuerpo se acostumbra a la nueva temperatura. Curiosamente, fue la última ley de la termodinámica en postularse, pero sus preceptos son fundamentales para los demás principios.
Primera ley: conservación de la energía

A esta ley se le conoce como “ley de la conservación de la energía” y establece que en un sistema cerrado la energía no se destruye ni se crea, sino que se transforma.

En todo sistema se conserva la energía a lo largo del tiempo. Por lo tanto, puede haber modificaciones en la misma, pero siempre se va a mantener la misma cantidad de energía. Igualmente, este principio se expresa mediante la siguiente fórmula matemática:
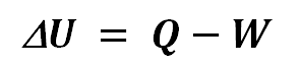
Cada una de las variables se desglosa de la siguiente manera:
- ΔU: variación de energía total de un sistema cerrado.
- Q: es igual al calor.
- W: el trabajo efectuado en el sistema.

Un ejemplo básico de esta primera ley de la termodinámica es el proceso de combustión que ocurre en el motor de un automóvil para que el auto se mueva.
Si se aplica este principio, se puede calcular el calor y el trabajo que genera el motor para comprobar que su energía, aunque sufrió ciertas transformaciones, se mantuvo constante a lo largo de todo el proceso.
Segunda ley: Entropía
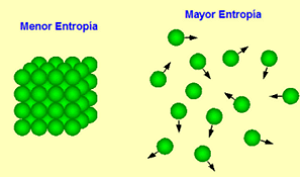
Esta segunda ley de la termodinámica postula que la entropía (S) en el universo tiende a incrementarse. Esto quiere decir, que dentro de cada sistema ocurre un proceso de entropía o desorden hasta que ocurre finalmente un equilibrio.
El máximo desorden, o el nivel mayor de entropía, es lo que conduce al equilibrio en cada sistema. El principio también plantea que los procesos naturales son irreversibles una vez que suceden, por ejemplo, cuando ocurre la radiación.
De igual manera, cuando el sistema realiza la transformación de energía, el calor que no se utiliza se desprende y aumenta la entropía, lo cual no es más que una medida para el desorden en el sistema cerrado. Esta ley se expresa con la siguiente fórmula:
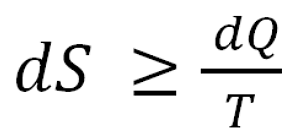
- dS: cambio de entropía.
- dQ: transferencia de calor.
- T: es la temperatura del sistema.
Un ejemplo ilustrativo de este principio es cuando se pone en contacto un cuerpo más frío con uno caliente. Esto hará que aumente la entropía o caos en ambos elementos y que el proceso no se pueda revertir.
Enunciado de Clausius
El enunciado de Clausius explica claramente que el calor no puede fluir espontáneamente de un elemento u objeto frío a otro con mayor calor. Solamente fluirá en esa dirección si se aplica un trabajo sobre el sistema.
Tal es el caso de los refrigeradores que operan en sentido inverso para poder realizan la transferencia térmica. Además, si no existe un trabajo adicional (conectar el refrigerador a la energía eléctrica) no se cumple el proceso.
Enunciado de Kelvin – Planck
Este enunciado se aplica a la segunda ley de la termodinámica y plantea que es imposible fabricar una máquina, cuyo resultado sea eficiente al 100%, puesto que siempre habrá un mínimo de desecho de calor.
Por lo general, el calor desprendido en el funcionamiento de la máquina es la mitad del calor total que se usó para el trabajo.
Tercera ley de la termodinámica
A este principio también se le denomina “el postulado de Nerst”, el cual establece que cuando la entropía en un sistema llega a cero absoluto en la escala de Kelvin "0" (K), se detendrán los procesos físicos y la entropía tendrá un valor mínimo que será constante.
Se puede representar mediante la siguiente fórmula:
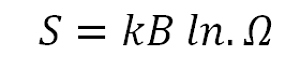
- S: es la entropía del sistema.
- KB: o constante de Boltzmann.
- Ω: el número de microestados presentes.
Es casi imposible llegar a un valor 0 de temperatura, sin embargo, el valor más aproximado y constante es a lo que se le denomina entropía residual en un sistema.
Historia y orígenes

Los cuatro principios de la termodinámica no se originaron al mismo tiempo ni de una sola fuente.
El primero de ellos que se estableció fue la segunda ley de la termodinámica, la cual surgió en el año 1824 por Nicolás Léonard Sadi Carnot, quien se basó en los estudios del conde Rumford.
Un dato curioso es que cuando se postula esta ley se clasifica como la primera del axioma y luego se modificó ese orden.
Posteriormente, en las investigaciones de William Thompson y Rudolf Clausius realizadas en 1860, se formalizó que el principio de la termodinámica, establecido hasta ese entonces, había evolucionado, por lo que se le adicionó la primera ley.
En el año 1912 surge la tercera ley de la termodinámica. Por último, pero de vital importancia para la comprensión de las leyes universales, se añade en el año 1930 a los principios de la termodinámica, la ley cero o del equilibrio térmico.
Referencias
- Cengel, Y. A., Boles, M. A., Campos Olguín, V., & Colli Serrano, M. T. (2003). Termodinámica. Disponible: http://metabase.uaem.mx/xmlui/bitstream/handle/123456789/2781/497_03.pdf
- GOBBI, A. I. Las Leyes de la Termodinámica. Instituto Nuestra Señora. Disponible en: https://www.ib.edu.ar/images/beca_ib_alum_niv_medio/trabajos/2007/Gobbi.pdf

Maestría en Educación Especial-Integral acreditada por la Universidad Latinoamericana y del Caribe (2016) y diplomado en Investigación educativa
(2019). Le apasiona leer, tomar una buena taza de café y disfrutar de una charla con sus amigos.