Energía Reticular

La energía reticular, o también llamada energía de red, es aquel tipo de energía que es liberado cuando se altera la estructura iónica de un compuesto, esto es, cuando se separa un mol del compuesto iónico en iones gaseosos, o cuando los iones gaseosos se unen para formar un compuesto. De esta forma, la energía reticular es una medida de la estabilidad de un compuesto iónico particular.
En química física, la energía reticular es considerada como exotérmica y similar a la entalpía (energía termodinámica de las reacciones químicas), en el sentido que ambas son representadas como tasas de unidades de energía por mol de sustancia. Sin embargo, a la energía reticular le corresponde el signo opuesto al de la entalpía, debido a la unión de iones gaseosos separados en el vacío forman una retícula iónica.
El estudio de la energía reticular inició durante las investigaciones de la estructura molecular de sales y minerales, compuestos como la sal común y la blenda. Posterior el estudio esta energía se extendió, y ahora abarca a metales, azucares, diamante, entre otros.
La medición de la energía reticular se realiza de manera indirecta mediante el uso de modelos iónicos, los cuales se construyen mediante las ecuaciones de la electrostática, siguiendo la ley de Coulomb. No obstante, también es posible estimar la energía reticular por medio de principios termodinámicos; en especial por la primera ley de la termodinámica, en los ciclos de Born-Haber.
Cómo se produce
La energía reticular se produce debido a alteraciones en estructuras iónicas, pudiendo ser una liberación o acumulación de energía termodinámica. Este tipo de energía puede ser producido por la separación de una cantidad dada de sustancia de un compuesto iónico, la cual está compuesta por iones en estado gaseoso. Asimismo, cuando iones gaseosos específicos reaccionan para formar un compuesto, se origina una acumulación de energía reticular.

Por lo tanto, en un nivel fundamental el origen de la energía reticular se debe a los enlaces iónicos entre corpúsculos cargados, representándose como una liberación o acumulación de energética, según se formen o se rompan los enlaces entre los iones. Por ejemplo, en la reacción que da lugar a la producción de la sal común, la energía reticular es liberada cuando reaccionan el catión gaseoso de sodio y el anión gaseoso de cloro, para formar cloruro de sodio (sal común).
Cómo funciona
El funcionamiento de la energía reticular es entendido por medio de modelos iónicos, en los cuales los cationes (ion positivo) y aniones (ion negativo) interaccionan y forman una red electrostática; solo en caso que el compuesto sea sólido. Aunque, también es posible vislumbrar el mecanismo de la energía reticular mediante experimentos termodinámicos de tipo cíclico.
- Enlace iónico: es aquel que resulta de la atracción electromagnética entre iones de carga opuesta, es decir, entre un catión y anión. En este enlace uno de los átomos cargados recibe el electrón del otro. La atracción electromagnética entre cationes y aniones posibilita la formación de compuestos, sin necesidad de que los átomos cargados se fusionen. Este tipo de enlace depende de la electronegatividad de ambos iones.
- Ley de Coulomb: es la base de los modelos iónicos, ya que permite conocer la fuerza electrostática con la cual se atraerán los cationes y aniones de una red, obedeciendo el principio de conservación de energía. Pero, lo más importante es que esta ley establece que la fuerza electrostática entre iones es directamente proporcional a su carga, e inversamente proporcional a la distancia que los separa.
- Ley de Hess: es un caso especial de la primera ley de la termodinámica, empleada para comprender los flujos de calor durante reacciones químicas. Esta ley enuncia que cuando los reactivos reaccionan para producir compuestos el calor, generado o absorbido, es independiente de la cantidad de etapas que le tome a la reacción para finalizar. Esto suele interpretarse como que en las reacciones químicas los flujos de energía termodinámica son aditivos.
- Ciclos de Born-Haber: estos ciclos surgen de la aplicación de la Ley de Hess, y permiten evaluar experimentalmente la energía reticular, analizando el ciclo termodinámico que se produce cuando la energía es directamente almacenada en la estructura de un compuesto iónico, producida por reactivos particulares, o cuando la energía es transferida indirectamente durante la formación del compuesto iónico.
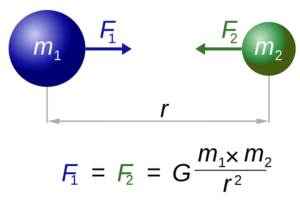
Ley de Coulomb
Fórmula matemática
La fórmula matemática de la energía reticular está dada por la electrostática del modelo iónico. Este modelo iónico generalmente es descrito por la ecuación de Born-Landé, que deriva la energía reticular del potencial eléctrico de la red iónica y de una energía potencial repulsiva.
[latex]U_{0}=-\frac{N_{A}*M*z^{+}*z^{-}*q^{2}}{4*\pi*\epsilon_{0}*r_{0}}*\frac{n-1}{n}[/latex]
Dónde:
- U0: energía reticular.
- NA: constante de Avogadro (6,02x1023mol-1)
- M: constante de Madelung
- z+: carga del catión.
- z-: carga del anión.
- q: carga fundamental del electrón.
- ε0: constante dieléctrica del vacío (8,85x10-12 C2*N-1*m-2).
- r0: distancia entre los iones.
- n: exponentes de Born.